Sáng 23/6, Bộ Y tế cho biết, theo quy định của Tổ chức Y tế Thế giới (WHO) và các nước như Mỹ, châu Âu, Nhật, Hàn Quốc… một loại vaccine trước khi đưa vào sử dụng khẩn cấp bắt buộc phải thử nghiệm lâm sàng trên người với 3 giai đoạn. Trong đó giai đoạn 3 là giai đoạn quan trọng nhất.
Giai đoạn này được thực hiện trên quy mô lớn với mục tiêu đánh giá tính an toàn và hiệu quả bảo vệ của vaccine. Kết quả của giai đoạn 3 sẽ quyết định việc vaccine đó được phê duyệt để triển khai tiêm chủng rộng rãi hay không. Kể cả sau khi đã được phê duyệt, các loại vaccine đó đều phải liên tục bổ sung, cập nhật các thông tin, dữ liệu liên quan đến tính an toàn, hiệu quả của vaccine trong quá trình sử dụng.
Thử nghiệm lâm sàng giai đoạn 1 và 2 được thực hiện ở quy mô nhỏ trên một số nhóm quần thể để kiểm tra độ an toàn, tính sinh miễn dịch và xác định liều lượng tối ưu. Việc đánh giá tính sinh miễn dịch trong giai đoạn 1 và 2 này không phải là yếu tố quyết định cho việc phê duyệt khẩn cấp. Chỉ có kết quả thử nghiệm lâm sàng giai đoạn 3 mới là yếu tố quyết định để đánh giá vaccine này có hiệu quả bảo vệ hay không, làm giảm nguy cơ mắc COVID-19 hay không hoặc giảm nhẹ tình trạng bệnh hay không.
Bắt buộc 3 giai đoạn thử nghiệm
Theo Bộ Y tế, trong bối cảnh dịch COVID-19 bùng phát rộng trên toàn thế giới, việc cấp phép khẩn cấp cho một loại vaccine phòng COVID-19 là điều cần thiết. Nhưng điều này không có nghĩa là bỏ qua các giai đoạn thử nghiệm lâm sàng bắt buộc.
Việc cấp phép khẩn cấp sử dụng vaccine COVID-19 hiện là do điều kiện dịch bệnh nên chưa đủ thời gian để theo dõi được vaccine trong thời gian dài như thông lệ. Mặc dù vậy, để đảm bảo tính an toàn của vaccine vẫn phải thực hiện đầy đủ quy trình đánh giá hiệu quả bảo vệ của vaccine.
Giống như thông lệ quốc tế, tất cả vaccine COVID-19 trước khi đưa vào sử dụng khẩn cấp tại Việt Nam đều phải tuân thủ thử nghiệm lâm sàng qua 3 giai đoạn, trên nguyên tắc đảm bảo 3 yếu tố: An toàn, sinh miễn dịch và quan trọng nhất là hiệu quả bảo vệ.
Đến nay, Việt Nam phê duyệt có điều kiện 4 loại vaccine COVID-19 bao gồm Comirnaty của Pfizer, A2D1222 của AstraZeneca, Sputnik-V của Gamalaya, Vero-Cell của Sinopharm cho nhu cầu cấp bách trong phòng chống dịch COVID. Ngoài ra, vaccine Moderna cũng đang trong quá trình xem xét phê duyệt.
Tất cả các vaccine nói trên đều phải trải qua 3 giai đoạn thử nghiệm lâm sàng. Trong đó, thử nghiệm lâm sàng giai đoạn 3 có quy mô từ 20.000 đến 50.000 người tham gia. Cụ thể, vaccine của AstraZeneca thử nghiệm lâm sàng giai đoạn 3 tại 11 quốc gia với 49.626 người tham gia. Vaccine Vero-Cell của Sinopharm thử nghiệm lâm sàng tại 6 quốc gia với trên 45.000 người. Vaccine Sputnik-V thử nghiệm lâm sàng tại 5 quốc gia với 21.977 người. Vaccine của Pfizer thử nghiệm lâm sàng tại 6 quốc gia với 43.418 người và vaccine của Moderna thử nghiệm tại 4 quốc gia với 30.420 người.
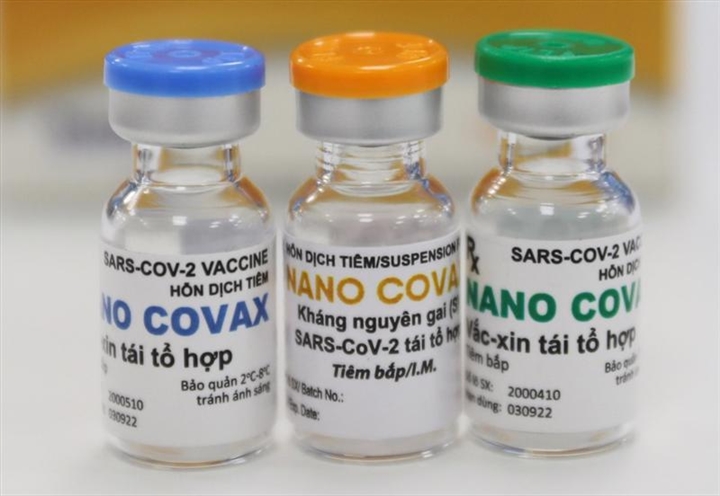
Cấp phép khẩn cấp Nano Covax là nóng vội
Chiều 22/6, Công ty cổ phần Công nghệ sinh học dược Nanogen (Nanogen), Khu công nghệ cao TP.HCM cho biết, đơn vị vừa có văn bản kiến nghị Thủ tướng xin cấp phép khẩn cấp cho vaccine phòng COVID-19 Nanocovax.
Ông Nguyễn Ngô Quang, Phó cục trưởng Cục Khoa học công nghệ và đào tạo (Bộ Y tế) cho rằng, kiến nghị này là quá sớm và nóng vội khi chưa đầy đủ các dữ liệu về mặt khoa học. Kiến nghị này rất khó được Bộ Y tế chấp thuận.
Để quyết định có cấp phép khẩn cấp hay không, Bộ Y tế cần có các dữ liệu khoa học cụ thể. Bộ sẽ dựa trên nguyên tắc có đầy đủ các dữ liệu chứng minh và trả lời được 3 câu hỏi lớn: Có an toàn không?. Có sinh miễn dịch không? Có hiệu lực bảo vệ không?
Trong khi đó, hiện vaccine Nano Covax mới đi qua giai đoạn 2 của cuộc thử nghiệm và theo đánh giá có sinh miễn dịch rất tốt. Tuy nhiên, việc nghiên cứu mới chỉ dừng lại trong phạm vi mấy trăm người, trong khi quy chuẩn thử nghiệm vaccine đòi hỏi số lượng người lớn hơn rất nhiều lần.
Tương tự giai đoạn 3 cũng mới chỉ tiêm xong mũi 1 cho 1.000 người và cỡ mẫu này vẫn chưa đủ để đánh giá. Trong khi theo kế hoạch cỡ mẫu giai đoạn 3 thử nghiệm trên 13.000 người.
Ngoài ra, sau tiêm thử nghiệm mũi 2 (sau 28 ngày), cơ quan chuyên môn cần phải tiếp tục đánh giá sau 36, 45, 56 ngày sau tiêm. Trên cơ sở đó mới đủ tiêu chuẩn đánh giá tính sinh miễn dịch và hiệu lực bảo vệ ra sao. Như vậy ít nhất phải sau 2 tháng và thử nghiệm trên cỡ mẫu này mới có thể đánh giá.
Phó cục trưởng Cục Khoa học công nghệ và đào tạo nhấn mạnh, vaccine Nano Covax còn đang trong quá trình nghiên cứu, thử nghiệm, chưa xong và chưa có dữ liệu cụ thể. Mặc dù kết quả đánh giá ban đầu là tính sinh miễn dịch tốt, nhưng miễn dịch này liệu có giảm được tỉ lệ mắc COVID-19, hoặc mắc rồi có giảm nhẹ tình trạng bệnh hay không thì chưa có kết quả.
Bộ Y tế hoàn toàn ủng hộ nghiên cứu phát triển vaccine trong nước để chủ động được nguồn vaccine của Việt Nam. Nhưng trước khi một loại vaccine đưa ra tiêm rộng rãi cho người dân, Bộ Y tế phải đảm bảo có đầy đủ các dữ liệu về an toàn, tính sinh miễn dịch và đặc biệt là hiệu lực bảo vệ.
Bộ Y tế sẽ phải giải trình với xã hội, với người dân "vaccine này có hiệu quả hay không", "căn cứ vào đâu để nói là hiệu quả" và "tại sao đồng ý cấp phép".
|
Nano Covax là vaccine phòng COVID-19 do Học viện Quân y phối hợp với Công ty Nanogen nghiên cứu phát triển. Đây là vaccine đầu tiên của Việt Nam thử nghiệm lâm sàng trên người dựa trên công nghệ tái tổ hợp protein.
Vaccine được thử nghiệm giai đoạn 1 bắt đầu từ ngày 17/12/2020. Đến ngày 8/4/2021 kết thúc giai đoạn 2 trên 560 tình nguyện viên từ 18 đến trên 60 tuổi. Trong giai đoạn 2, các tình nguyện viên được chia 4 nhóm, tiêm 3 mức liều 25mcg, 50mcg, 75mcg và nhóm còn lại tiêm giả dược.
Kết quả giai đoạn 2, cả 3 mức liều đều đảm bảo an toàn, 100% người tiêm đều sinh miễn dịch ở các mức độ khác nhau.
Ngày 22/6, Học viện Quân y vừa hoàn thành 1.000 mũi tiêm đầu tiên vaccine Nano Covax giai đoạn 3 cho các tình nguyện viên. |
(Theo VTC)