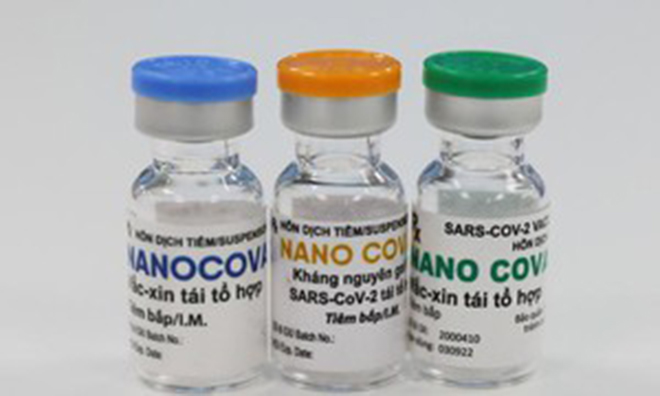
Báo cáo của Bộ Y tế mới đây cho biết, vắc xin Nanocovax đã nghiệm thu kết quả thử nghiệm lâm sàng giai đoạn 1 vào tháng 8/2021. Vắc xin này đã được Hội đồng đạo đức trong nghiên cứu y sinh học quốc gia đánh giá kết quả giữa kì thử nghiệm lâm sàng giai đoạn 3 với dữ liệu tính đến ngày 13/12/2021. Hiện đang tiếp tục thu thập dữ liệu đánh giá tính an toàn, tính sinh miễn dịch và hiệu quả bảo vệ thử nghiệm lâm sàng giai đoạn 2 và giai đoạn 3 của vắc xin theo đề cương nghiên cứu. Hội Đồng tư vấn cấp giấy đăng kí lưu hành thuốc và nguyên liệu làm thuốc đã họp thẩm định hồ sơ đăng kí lưu hành vắc xin này và đề nghị công ty sản xuất, các đơn vị nghiên cứu khẳng định về tính chính xác của dữ liệu nghiên cứu.
Vắc xin Nanocovax của công ty Nanogen đã được tổ chức triển khai nghiên cứu vào tháng 5/2020 - ngay khi đại dịch COVID-19 bắt đầu bùng phát mạnh trên thế giới.
Vắc xin này hoàn toàn mới, được sản xuất dựa trên công nghệ protein tái tổ hợp. Điều quan trọng nhất và mất nhiều thời gian nhất là việc Nanogen lựa chọn đoạn gene, đoạn protein để thiết kế ra đoạn gene phù hợp với những biến chủng COVID-19 đang lây lan mạnh ở Việt Nam, rồi từ đó mới sản xuất ra vắc xin ngừa COVID-19.
Theo đề cương đã được phê duyệt, giai đoạn 3 tiêm thử nghiệm vắc xin Nanocovax nhằm đánh giá yếu tố hiệu lực bảo vệ của vắc xin đối với cộng đồng và được thực hiện tại nhiều trung tâm trong nước với 13.000 người; chỉ thực hiện tiêm nhóm liều duy nhất 25 mcg và nhóm tiêm giả dược đối chứng.
Ứng viên vắc xin COVIVAC của Viện Vắc xin và sinh phẩm Nha Trang đã đánh giá kết quả giữa kỳ thử nghiệm lâm sàng giai đoạn 1; đã hoàn thành tiêm 2 liều của thử nghiệm lâm sàng giai đoạn 2. Nhóm nghiên cứu đã hoàn thành báo cáo giữa kỳ thử nghiệm lâm sàng giai đoạn 2, đang hoàn thiện đề cương thử nghiệm lâm sàng giai đoạn 3.
Ứng viên vắc xin ARCT-154 là vắc xin mRNA của Công ty Acturus - Hoa Kỳ được Tập đoàn VinGroup đàm phán để chuyển giao công nghệ về Việt Nam, đã hoàn thành tiêm 2 mũi của thử nghiệm lâm sàng giai đoạn 2 và 3a, 3b, 3c. Đang thu thập, xử lý, phân tích dữ liệu nghiên cứu để đánh giá kết quả giữa kỳ thử nghiệm lâm sàng giai đoạn 3 phục vụ xem xét cấp giấy đăng ký lưu hành trong trường hợp cấp bách.
Bên cạnh đẩy nhanh tiến độ nghiên cứu, sản xuất vắc xin COVID-19 do Việt Nam sản xuất nhằm chủ động nguồn vắc xin trong nước cho người từ 18 tuổi trở lên, Bộ Y tế cũng chỉ đạo các đơn vị quan tâm nghiên cứu các loại vắc xin phòng ngừa các biến thể mới; thích ứng với các độ tuổi khác nhau bao gồm vắc xin cho trẻ em.
Để bảo đảm tính thống nhất, công bằng trong xem xét, đánh giá kết quả thử nghiệm lâm sàng đối với các vắc xin COVID-19 sản xuất trong nước, trên cơ sở các hướng dẫn của Tổ chức Y tế Thế giới, kinh nghiệm của các quốc gia, thực tiễn của Việt Nam và ý kiến của các chuyên gia, ngày 11/11/2021, Bộ Y tế đã ban hành "Hướng dẫn chuyên môn về xem xét tính an toàn và hiệu quả bảo vệ phục vụ đánh giá kết quả giữa kỳ thử nghiệm lâm sàng giai đoạn 3 của vắc xin phòng COVID-19 sản xuất trong nước”. Đây là tài liệu chuyên môn để các cơ sở nghiên cứu sản xuất vắc xin phòng COVID-19 trong nước, Hội đồng đạo đức trong nghiên cứu y sinh học các cấp, các Hội đồng chuyên môn của Bộ Y tế và các cơ quan, tổ chức, cá nhân có liên quan tham khảo khi xây dựng và đánh giá báo cáo kết quả giữa kỳ thử nghiệm lâm sàng giai đoạn 3 vắc xin phòng COVID-19 sản xuất trong nước.
Tiếp tục nghiên cứu, thử nghiệm lâm sàng
Tại cuộc họp giữa lãnh đạo Bộ Y tế với các đơn vị nghiên cứu sản xuất vắc xin mới đây, các ý kiến đã thống nhất về việc nghiên cứu thử nghiệm lâm sàng đối với 3 vắc xin nội gồm COVIVAC, NanoCovax và ARCT-154.
Đối với COVIVAC, Bộ yêu cầu Cục Y tế dự phòng tiếp tục tham mưu cho lãnh đạo Bộ về việc tiêm liều nhắc lại theo hướng vừa triển khai vừa đánh giá như kinh nghiệm các nước. Đồng thời, đề nghị Cục Quản lí Dược làm đầu mối xây dựng, ban hành hướng dẫn tiêu chí cấp phép cho vắc xin liều nhắc lại, hoàn thành trước ngày 30/3. Cùng với đó, kết hợp với Cục Khoa học Công nghệ - Đào tạo xin ý kiến các hội đồng.
Bộ giao Cục Khoa học Công nghệ - Đào tạo hướng dẫn xây dựng đề cương nghiên cứu thử nghiệm lâm sàng liều nhắc lại. Còn Vụ Kế hoạch Tài chính làm đầu mối hướng dẫn thủ tục cấp kinh phí cho dự án nghiên cứu từ nguồn ngân sách nhà nước, định hướng đề xuất đề tài cấp Quốc gia.
Ngày 18/3, Văn phòng Chính phủ có văn bản truyền đạt ý kiến của Phó Thủ tướng Vũ Đức Đam về kết quả xem xét việc cấp giấy đăng kí lưu hành vắc xin Nanocovax.
Theo đó, xét báo cáo của Bộ Y tế về kết quả xem xét hồ sơ đề nghị cấp giấy đăng kí lưu hành vắc xin Nanocovax phòng COVID-19 do Công ty Cổ phần công nghệ sinh học dược Nanogen đăng kí và sản xuất, Phó Thủ tướng Vũ Đức Đam đề nghị Bộ Y tế khẩn trương thực hiện nghiêm chỉ đạo của Thủ tướng Chính phủ tại văn bản số 1027/VPCP-KGVX ngày 17/2/2022 của Văn phòng Chính phủ và các văn bản khác có liên quan; tiếp tục hướng dẫn, hỗ trợ doanh nghiệp trong mọi trường hợp theo quy định của pháp luật.
(Theo TPO)