Phương pháp điều trị đầu tiên trên thế giới sử dụng công nghệ chỉnh sửa gien CRISPR đã được phê duyệt.
Exa-cel, còn được biết đến với tên thương hiệu Casgevy, lần đầu tiên được phê duyệt vào ngày 16/11 vừa qua từ Cơ quan quản lý thuốc và sản phẩm chăm sóc sức khỏe (MHRA) của Vương quốc Anh để điều trị hai chứng rối loạn máu gây suy nhược: bệnh hồng cầu hình liềm và beta phụ thuộc vào truyền máu. -thalassemia.
Các cố vấn của Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) đã xác định rằng, biện pháp này an toàn khi sử dụng lâm sàng vào cuối tháng 10 và chính FDA dự kiến sẽ đưa ra phán quyết về việc có phê duyệt phương pháp điều trị này vào tháng 12.
Quyết định lịch sử của MHRA phê duyệt Casgevy có thể báo hiệu sự khởi đầu một kỷ nguyên mới của liệu pháp gien.
Liệu pháp CRISPR được phê duyệt đầu tiên điều trị bệnh gì?
MHRA đã phê duyệt Casgevy để điều trị bệnh hồng cầu hình liềm (SCD) và bệnh beta-thalassemia phụ thuộc vào truyền máu. Đây là những rối loạn di truyền kéo dài suốt đời do đột biến gien mã hóa huyết sắc tố, một loại protein mà tế bào hồng cầu cần để vận chuyển oxy đi khắp cơ thể.
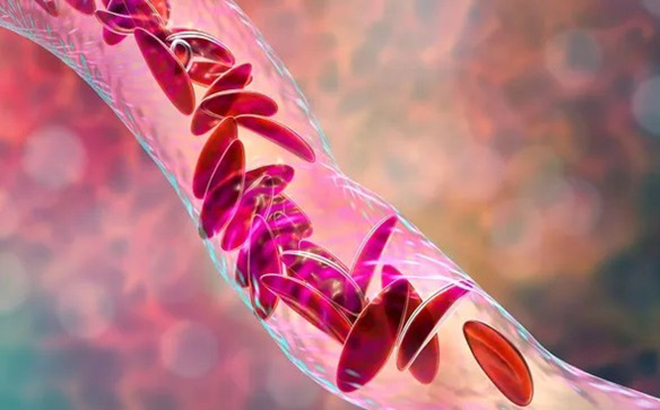
Ước tính có hơn 100.000 người ở Mỹ mắc SCD, nhưng tỷ lệ này ở một số nhóm dân số cao hơn những nhóm khác. Ví dụ: cứ 365 trẻ da đen sinh ra thì có 1 trẻ bị SCD. Căn bệnh này làm thay đổi hình dạng tế bào hồng cầu của một người để chúng trở thành hình chữ C chứ không phải hình tròn. Các tế bào hình lưỡi liềm chết đi nhanh chóng và cũng dính vào nhau làm tắc nghẽn mạch máu. Kết quả là bệnh nhân bị thiếu máu và thường trải qua những cơn đau dữ dội gọi là cơn đau.
Beta-thalassemia ảnh hưởng đến khoảng 1 trên 100.000 người trên toàn thế giới và nó ảnh hưởng không đều đến những người gốc Địa Trung Hải, Châu Á, Châu Phi và Trung Đông.
Bệnh nhân mắc bệnh beta-thalassemia không sản xuất đủ huyết sắc tố, có thể dẫn đến thiếu máu trầm trọng, trong khi bệnh thiếu máu hồng cầu hình liềm bắt nguồn từ việc thiếu tế bào hồng cầu khỏe mạnh. "Phụ thuộc vào truyền máu” có nghĩa là bệnh nặng đến mức bệnh nhân phải truyền hồng cầu thường xuyên trong suốt cuộc đời.
Casgevy hoạt động như thế nào?
Casgevy dựa trên kỹ thuật chỉnh sửa gen mang tính cách mạng có tên CRISPR, được phát triển lần đầu tiên vào năm 2012.
Hệ thống CRISPR cắt gien ra khỏi ADN bằng cách sử dụng enzyme có tên Cas9. Những chiếc "kéo phân tử” này được phân tử RNA hướng dẫn đến ADN mục tiêu. Công nghệ này được điều chỉnh từ cơ chế bảo vệ tự nhiên mà vi khuẩn và các sinh vật đơn giản khác gọi là vi khuẩn cổ sử dụng để chống lại virus.
Casgevy nhắm tới một gien có tên BCL11A. Gien mã hóa một loại protein thường điều chỉnh quá trình chuyển đổi từ phiên bản huyết sắc tố bào thai sang phiên bản trưởng thành ngay sau khi sinh. Tuy nhiên, ở những bệnh nhân bị SCD và beta-thalassemia, huyết sắc tố trưởng thành bị khiếm khuyết.
Mục tiêu của Casgevy là vô hiệu hóa BCL11A và do đó cho phép cơ thể tiếp tục tạo ra huyết sắc tố của thai nhi, vì phiên bản dành cho người lớn không hoạt động.
Để làm được điều này, tế bào gốc tạo máu được lấy từ tủy xương của bệnh nhân và gien BCL11A được chỉnh sửa bằng Casgevy trong phòng thí nghiệm. Các tế bào mới được sửa đổi có chứa huyết sắc tố hoạt động sau đó sẽ được truyền trở lại cơ thể bệnh nhân. Trước khi truyền, bệnh nhân phải dùng một loại thuốc hóa trị gọi là busulfan để loại bỏ các tế bào chưa được chỉnh sửa vẫn còn trong tủy xương.
Quá trình được chỉnh sửa này sẽ kéo dài. MHRA cho biết trong một tuyên bố: "Bệnh nhân có thể cần phải dành ít nhất một tháng trong bệnh viện trong khi các tế bào được điều trị sẽ cư trú trong tủy xương và bắt đầu tạo ra các tế bào hồng cầu có dạng huyết sắc tố ổn định”.
Trong hai thử nghiệm lâm sàng giai đoạn cuối, Casgevy đã phục hồi việc sản xuất huyết sắc tố ở hầu hết bệnh nhân bị SCD và beta-thalassemia và làm giảm bớt các triệu chứng của họ. 28/ 29 bệnh nhân bị SCD không trải qua bất kỳ cơn đau dữ dội nào trong ít nhất một năm sau khi được điều trị bằng Casgevy. Tương tự, 39 trong số 42 bệnh nhân mắc bệnh beta-thalassemia không cần truyền hồng cầu trong cùng thời gian sau điều trị. Ba bệnh nhân còn lại có nguy cơ cần truyền máu ít hơn 70%.
Casgevy có an toàn không?
Không có mối lo ngại nghiêm trọng nào về an toàn được nêu ra trong cả hai thử nghiệm lâm sàng giai đoạn cuối của Casgevy, mặc dù một số tác dụng phụ thoáng qua như sốt và mệt mỏi đã được báo cáo. Cả hai thử nghiệm này đều đang diễn ra và tính an toàn lâu dài của Casgevy tiếp tục được giám sát bởi các cơ quan quản lý, chẳng hạn như MHRA và FDA, cũng như bởi các nhà sản xuất liệu pháp này, Vertex Pharmaceuticals và CRISPR Therapeutics.
Tuy nhiên, nhìn chung vẫn còn một số lo ngại về tính an toàn của các liệu pháp dựa trên CRISPR. Cụ thể là có những lo ngại về tác động "ngoài mục tiêu”, xảy ra khi Cas9 tác động lên các phần khác của bộ gien mà không được dự định thay đổi và gây ra các tác dụng phụ không mong muốn.
David Rueda, chủ tịch Khoa Sinh lý học Phân tử và Tế bào tại Đại học Hoàng gia London, nói với Trung tâm Truyền thông Khoa học Vương quốc Anh: "Người ta biết rõ rằng CRISPR có thể dẫn đến việc chỉnh sửa gien giả mà không gây ra hậu quả gì đối với các tế bào được xử lý”.
(Theo TPO)