Bộ Y tế thông tin về loại thuốc điều trị ung thư khiến 12 người mù mắt tại Pakistan
- Cập nhật: Thứ năm, 28/9/2023 | 2:39:04 PM
Chiều 27/9, Cục Quản lý Dược (Bộ Y tế) thông tin về loại thuốc điều trị ung thư Avastin của hãng dược Roche (Thụy Sĩ) đang bị điều tra tại Pakistan do có 12 bệnh nhân bị mù sau khi tiêm thuốc.

|
|
Thuốc Avastin.
|
Các tin khác

Theo bản tin từ Trung tâm Dự báo khí tượng thủy văn Quốc gia, từ ngày 27 - 28/9, khu vực từ Thanh Hóa đến Nghệ An có mưa rất to; từ 60 - 120mm, có nơi trên 200mm.
Theo đó, Bộ Y tế cho biết đã xây dựng kế hoạch kiểm soát, hướng dẫn giám sát, điều trị liên quan đến dịch COVID-19 để các địa phương thực hiện khi công bố hết dịch COVID-19 nhóm A.

Sau mưa bão, lũ lụt có rất nhiều vi sinh vật, bụi, rác, chất thải… theo dòng nước tràn ra nhiều nơi, gây ô nhiễm môi trường và tiềm ẩn nhiều nguy cơ dịch bệnh. Để hỗ trợ người dân vùng lũ Mù Cang Chải, ngành y tế tỉnh đã triển khai các giải pháp khắc phục, xử lý nguồn nước và vệ sinh môi trường, hạn chế đến mức thấp nhất dịch bệnh xảy ra trên địa bàn.
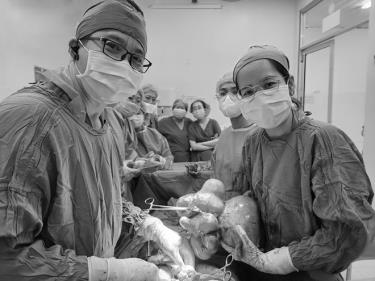
Ngày 26/9, Bệnh viện Phụ sản TP. Cần Thơ cho biết đã phẫu thuật thành công trường hợp bệnh nhân bị u xơ tử cung kích thước lớn, thiếu máu nặng.













